伴隨罕見病目錄面世、2022國談加速罕見病藥準(zhǔn)入等系列政策的出臺,我國罕見病藥物的研發(fā)與生產(chǎn)日趨火熱。據(jù)米內(nèi)網(wǎng)統(tǒng)計(jì),2022年共有14款罕見病藥獲批上市,包括人福藥業(yè)的罕見難治性癲癇藥氯巴占片、豪森藥業(yè)的遺傳性血管性水腫治療藥醋酸艾替班特注射液等;7款罕見病藥納入新版醫(yī)保目錄,多款單價過萬元產(chǎn)品位列其中;11款罕見病新藥進(jìn)入報(bào)產(chǎn)在審階段,沖刺上市指日可待。
激勵政策層出不窮,罕見病藥市場邁向千億時代
日前,國家衛(wèi)健委發(fā)布一份針對《關(guān)于加大對罕見病診治投入力度的建議》的答復(fù)。其中提及,國家衛(wèi)健委將繼續(xù)推進(jìn)罕見病目錄制訂工作程序,適時調(diào)整更新第二批罕見病目錄。此外,中華醫(yī)學(xué)會擬成立首個國家級罕見病權(quán)威醫(yī)學(xué)組織,即中華醫(yī)學(xué)會罕見病分會。
來源:國家衛(wèi)健委官網(wǎng)
事實(shí)上,國家為鼓勵藥企加大對罕見病藥的研發(fā)和生產(chǎn),近年來相繼出臺了一系列鼓勵政策。
2018年5月,國家衛(wèi)健委、工業(yè)和信息化部、國家藥監(jiān)局等五部門聯(lián)合發(fā)布《第一批罕見病目錄》,共涉及121種罕見?。ㄎ哪└讲》N目錄),為各部門制定罕見病相關(guān)政策提供重要依據(jù)。2022年11月,中國罕見病聯(lián)盟召開2022年中國罕見病大會稱,2022年國家醫(yī)保藥品目錄調(diào)整,對罕見病用藥開通單獨(dú)申報(bào)渠道,支持其優(yōu)先進(jìn)入醫(yī)保藥品目錄......
近十年國家發(fā)布的部分鼓勵罕見病藥研發(fā)和生產(chǎn)的相關(guān)政策
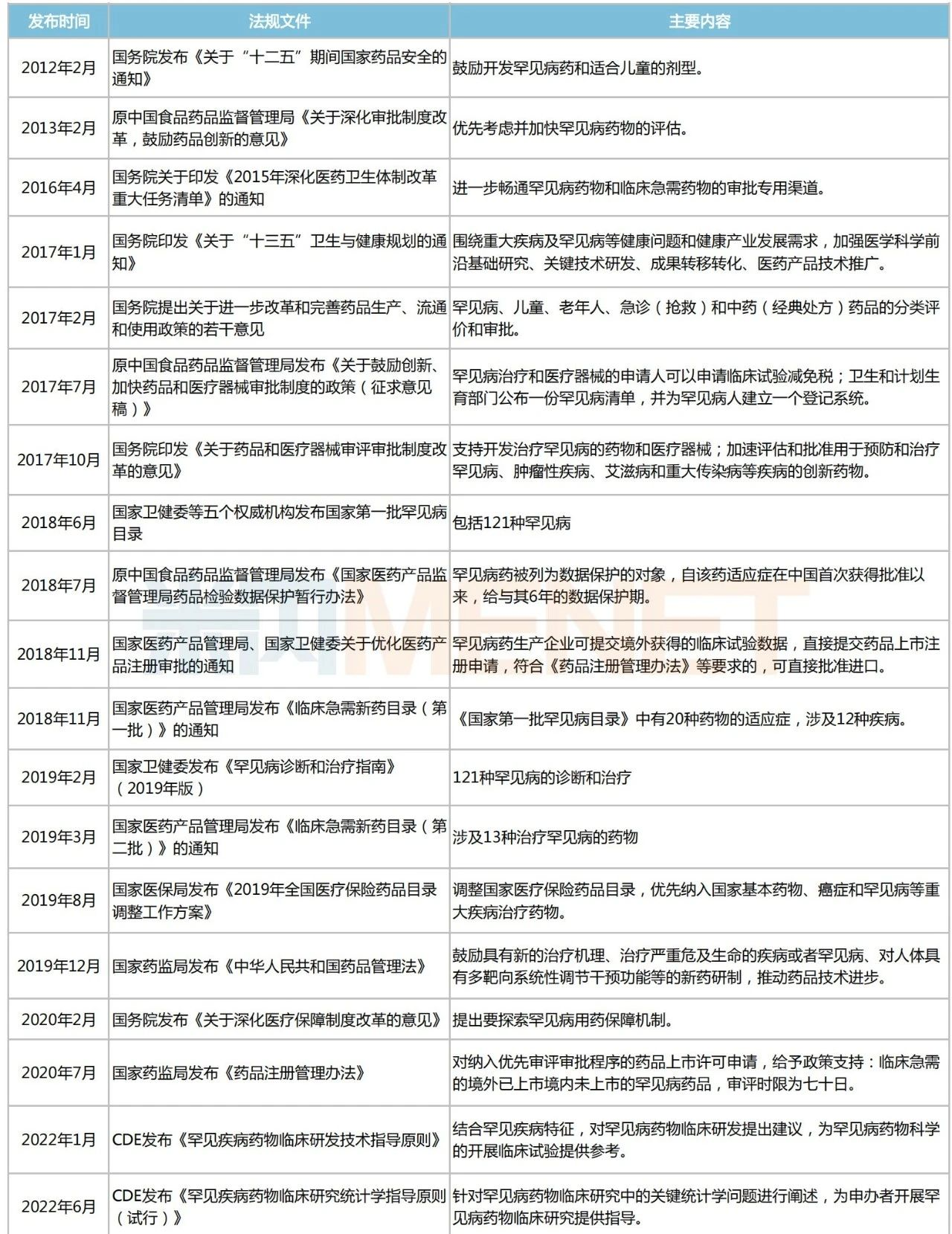

來源:國家衛(wèi)健委、國家藥監(jiān)局等,米內(nèi)網(wǎng)整理
統(tǒng)計(jì)數(shù)據(jù)顯示,罕見病在人群中的患病率大約在3.5%-5.9%,雖然84.5%的病種患病率不足百萬分之一,但是中國罕見病患者總數(shù)已有約2000萬人,并以每年新增超過20萬患者的速度增長。鑒于我國龐大的人口基數(shù),相對于其他國家和地區(qū),很多罕見病在我國已經(jīng)變得“不罕見”。
在臨床用藥需求推動下,罕見病藥物市場持續(xù)升溫。有業(yè)內(nèi)專業(yè)機(jī)構(gòu)指出,中國罕見病藥市場于2016年及2020年分別占全球罕見病市場的0.4%及1%,預(yù)計(jì)2030年將激增至259億美元,約合1755億元(按實(shí)時匯率換算,下同)。
14款罕見病藥誕生,7大品種加速進(jìn)保
伴隨利好政策和臨床需求的雙輪驅(qū)動,越來越多藥企積極投身到罕見病藥的研發(fā)當(dāng)中。據(jù)統(tǒng)計(jì),目前我國有70多款罕見病藥獲批上市,其中有14款于2022年登場亮相,包括人福藥業(yè)的罕見難治性癲癇藥氯巴占片、豪森藥業(yè)的遺傳性血管性水腫治療藥醋酸艾替班特注射液、兆科藥業(yè)的肌萎縮側(cè)索硬化治療藥利魯唑口服混懸液及特發(fā)性肺動脈高壓治療藥吸入用一氧化氮等。
2022年中國獲批上市的罕見病藥
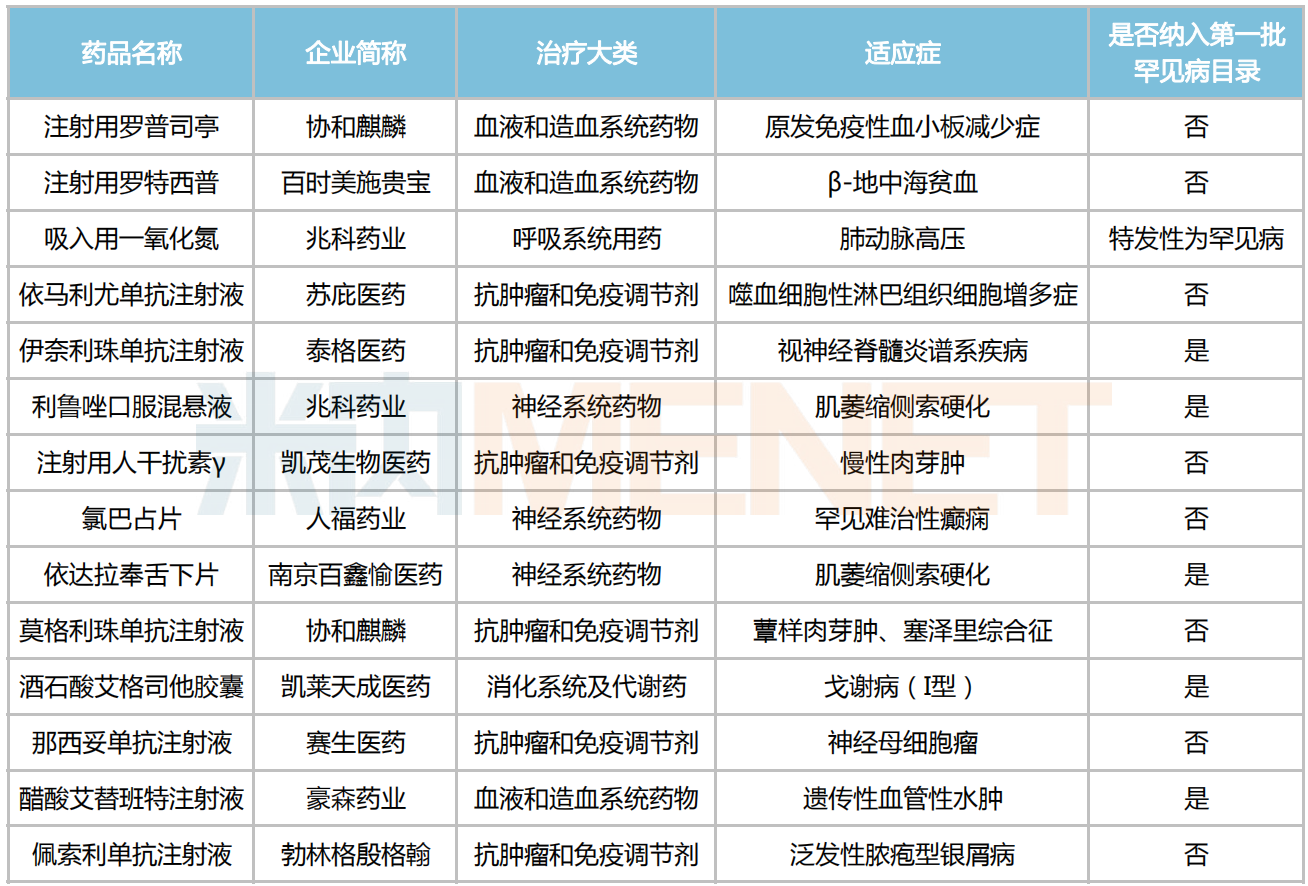
來源:米內(nèi)網(wǎng)中國申報(bào)進(jìn)度(MED)數(shù)據(jù)庫
此外,60多款罕見病藥已通過談判納入國家醫(yī)保目錄。值得注意的是,2022醫(yī)保目錄調(diào)整中明顯加大了對罕見病藥的關(guān)注,最終有7款藥物成功納入,包括兆科藥業(yè)的肺動脈高壓治療藥曲前列尼爾注射液、豪森藥業(yè)用于治療視神經(jīng)脊髓炎的伊奈利珠單抗注射液、諾華用于復(fù)發(fā)型多發(fā)性硬化的奧法妥木單抗注射液、羅氏用于脊髓型萎縮癥的利司撲蘭口服溶液用散等。
新增進(jìn)入2022醫(yī)保目錄的罕見病藥
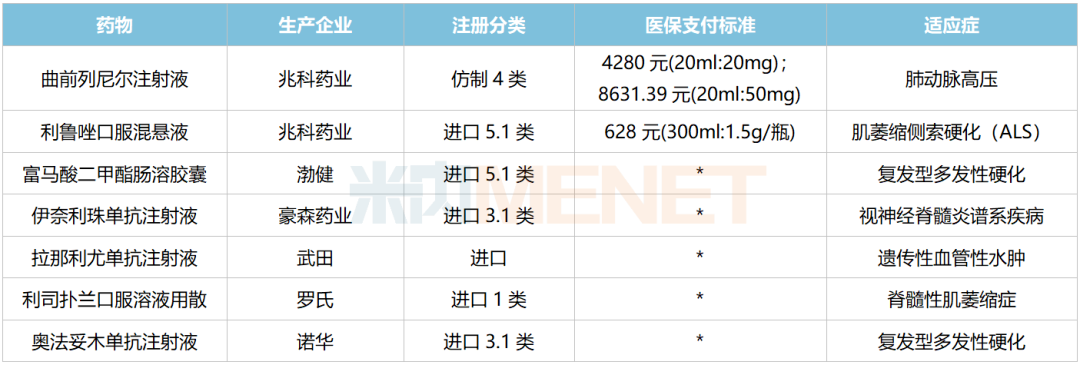
來源:國家醫(yī)保局,米內(nèi)網(wǎng)整理
米內(nèi)網(wǎng)數(shù)據(jù)顯示,近年來曲前列尼爾注射液在中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機(jī)構(gòu))終端銷售額增速驚人,2021年同比增長186.89%,順利進(jìn)入醫(yī)保后將進(jìn)一步放量。
近年來中國公立醫(yī)療機(jī)構(gòu)終端曲前列尼爾注射液銷售趨勢(單位:萬元)
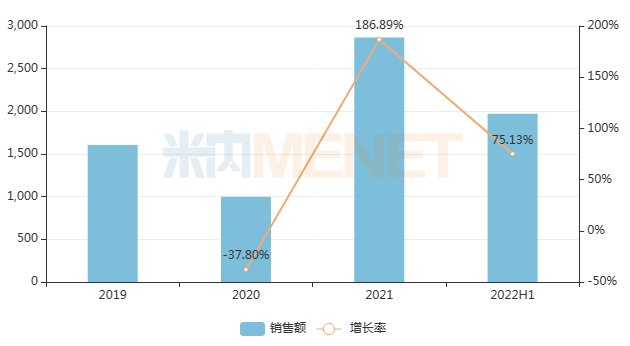
來源:米內(nèi)網(wǎng)中國公立醫(yī)療機(jī)構(gòu)藥品終端競爭格局
豪森藥業(yè)引進(jìn)的伊奈利珠單抗注射液是國內(nèi)首款、也是目前唯一一款獲批上市的CD19單抗,用于視神經(jīng)脊髓炎譜系疾病成人患者的治療,為該適應(yīng)癥首個納入國家醫(yī)保的藥品;羅氏的利司撲蘭口服溶液用散適用于脊髓性肌萎縮癥(SMA),是首個在中國獲批治療SMA的口服疾病修正治療藥;諾華的奧法妥木單抗注射液屬于抗人CD20的全人源免疫球蛋白G1單抗,用于治療復(fù)發(fā)型多發(fā)性硬化。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,上述3款產(chǎn)品進(jìn)醫(yī)保前在國內(nèi)的最低單價均超過1萬元,通過談判降價進(jìn)入醫(yī)保,不僅填補(bǔ)了這些罕見病藥的市場空白,更能大幅提高患者的用藥可及性。
部分罕見病藥進(jìn)保前國內(nèi)中標(biāo)價格(單位:元)
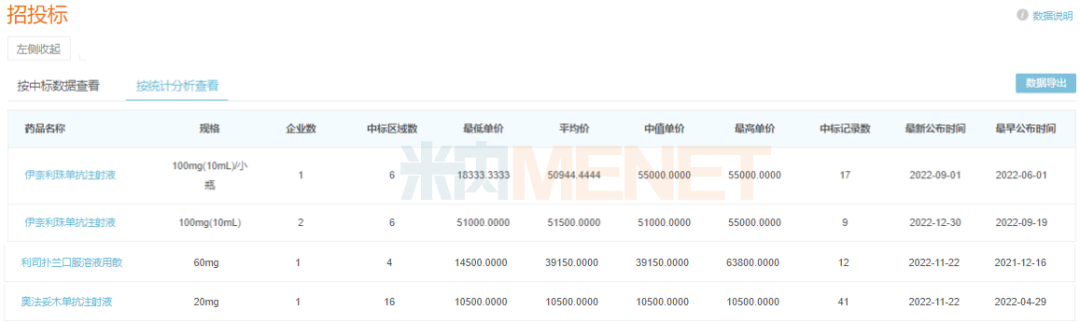
來源:米內(nèi)網(wǎng)招投標(biāo)數(shù)據(jù)庫
11款罕見病新藥有望登場,再鼎、武田、羅氏.......火力全開
罕見病藥進(jìn)保提速,為產(chǎn)品放量、新藥研發(fā)注入了一劑“強(qiáng)心針”。2023年伊始,又有哪些備受關(guān)注的罕見病新藥登場亮相?筆者結(jié)合公開資料及CDE受理情況,篩選出11款有望于今年獲批上市的罕見病新藥。
2023年有望獲批上市的罕見病新藥
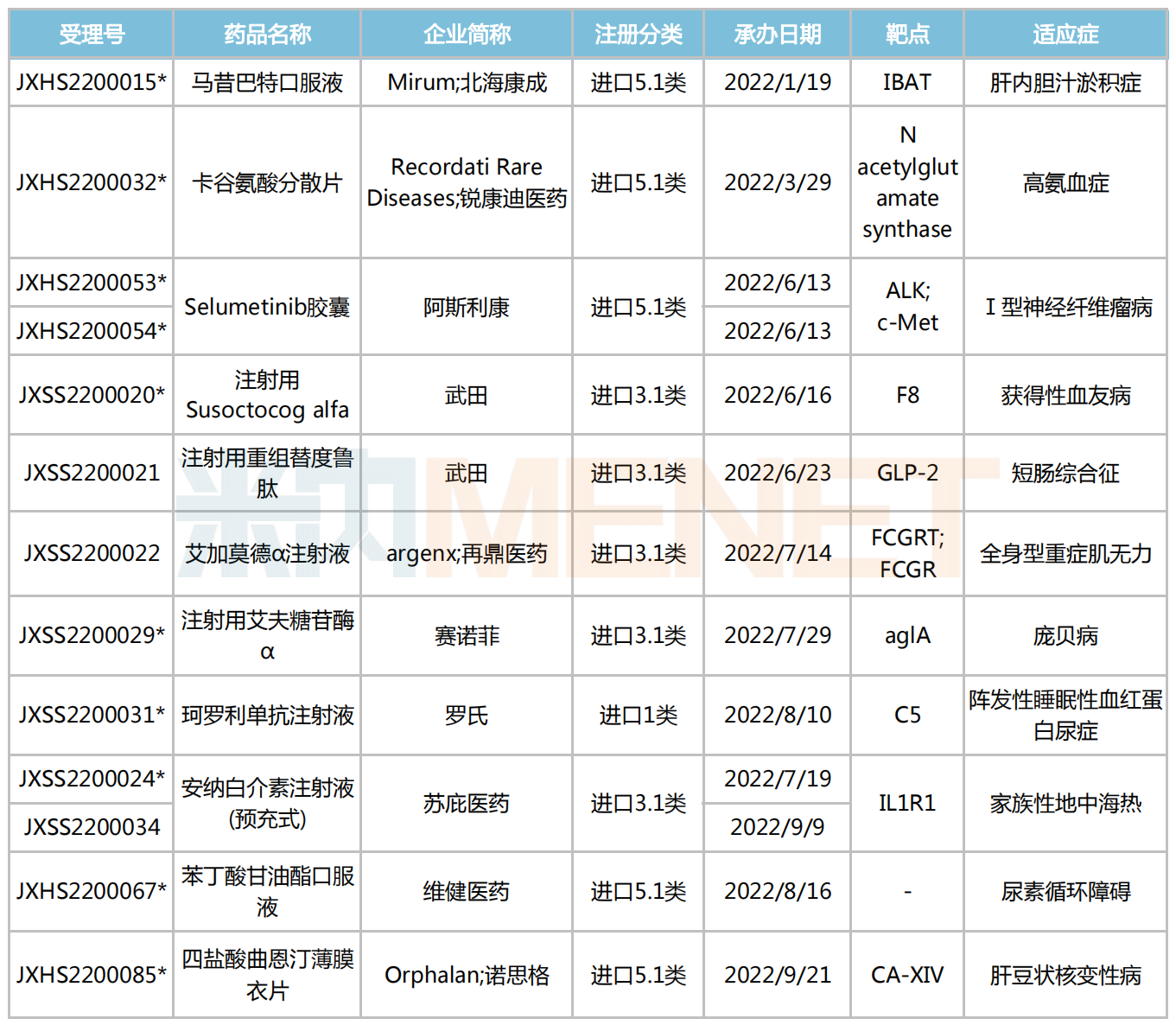
注:帶*為納入優(yōu)先審評
來源:米內(nèi)網(wǎng)中國申報(bào)進(jìn)度(MED)數(shù)據(jù)庫
艾加莫德α注射液是argenx開發(fā)的一款靶向FcRn的抗體片段,再鼎醫(yī)藥擁有該藥在大中華區(qū)的獨(dú)家開發(fā)和商業(yè)化權(quán)利。2022年7月,該藥的新藥上市申請(JXSS2200022)獲CDE受理,用于治療全身型重癥肌無力患者。
根據(jù)再鼎醫(yī)藥新聞稿介紹,艾加莫德α注射液是首個在美國和日本獲批用于成人全身型重癥肌無力治療的FcRn拮抗劑,并已成功落地我國海南博鰲樂城國際醫(yī)療旅游先行區(qū)。2022年6月,海南省人民醫(yī)院樂城分院在國內(nèi)開出該藥首個處方,預(yù)示著三十年來我國重癥肌無力藥物即將開啟的新突破。
來源:海南省人民醫(yī)院官微
武田有2款罕見病新藥有望在今年獲批上市,其中,注射用Susoctocog alfa屬于重組抗血友病因子(豬序列),它與人序列凝血因子Ⅷ結(jié)構(gòu)相似、序列同源,且不易受到抗人FⅧ自身抗體的滅活,可以替代人FⅧ發(fā)揮明顯的止血作用。
據(jù)悉,注射用Susoctocog alfa是首個獲得美國FDA及歐洲EMA批準(zhǔn)用于獲得性血友病的重組豬FⅧ藥物。2022年6月,該藥的上市申請(JXSS2200020)獲CDE受理,隨后被納入優(yōu)先審評,擬用于獲得性血友病A成人患者按需治療和出血事件的控制。
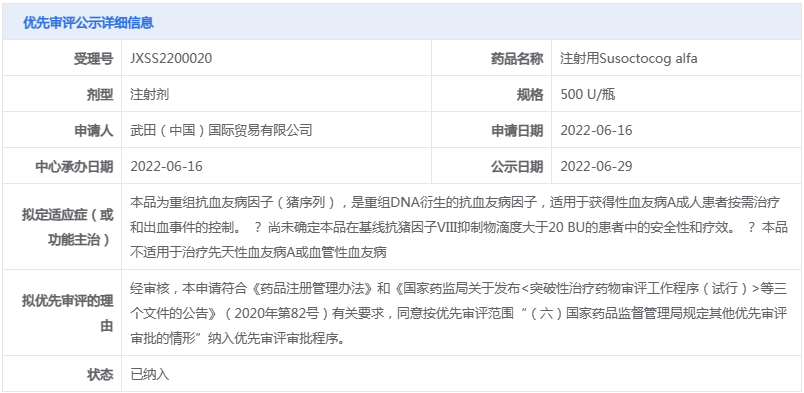
來源:CDE官網(wǎng)
注射用重組替度魯肽是一款人胰高血糖素樣肽2(GLP-2)類似物,通過增加小腸絨毛的長度和隱窩的深度來提高腸道的吸收能力。目前,該藥已分別被美國、歐盟、日本等國家作為孤兒藥獲批,用于罕見病成人/兒童短腸綜合征的治療。米內(nèi)網(wǎng)數(shù)據(jù)顯示,武田的注射用重組替度魯肽2021年全球銷售額757億日元(約合5.7億美元),同比增長17%,產(chǎn)品潛力可期。
注射用重組替度魯肽全球銷售情況

來源:米內(nèi)網(wǎng)跨國上市公司數(shù)據(jù)庫
珂羅利單抗注射液是羅氏在研的一種C5補(bǔ)體抑制劑,可以阻斷補(bǔ)體C5裂解為C5a和C5b,抑制補(bǔ)體活化。此前,該藥擬用于治療陣發(fā)性睡眠性血紅蛋白尿癥(PNH)的適應(yīng)癥已在中國被納入突破性治療品種和優(yōu)先審評。
除針對PNH適應(yīng)癥在中國申報(bào)上市外,珂羅利單抗該適應(yīng)癥在全球近20個國家及地區(qū)均已進(jìn)入Ⅲ期臨床,包括美國、歐洲、日本、澳大利亞等。從研發(fā)進(jìn)度看,該藥有望成為羅氏史上首個以中國作為全球首發(fā)的創(chuàng)新藥。
珂羅利單抗PNH適應(yīng)癥全球研發(fā)進(jìn)度(Ⅲ期臨床及以上)
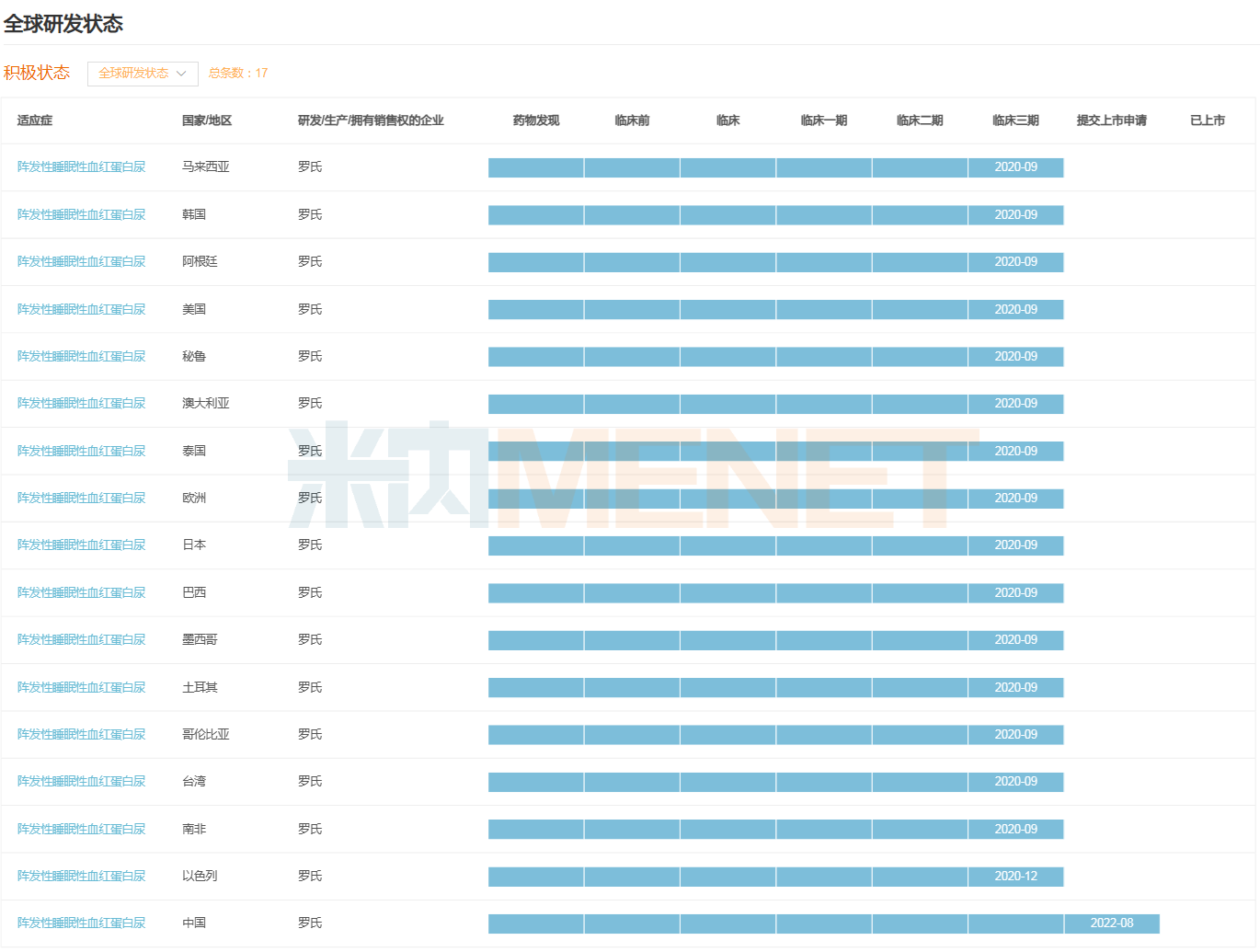
來源:米內(nèi)網(wǎng)全球藥物研發(fā)數(shù)據(jù)庫
注射用艾夫糖苷酶α是賽諾菲開發(fā)的第二代酶替代療法,能夠特異性靶向細(xì)胞攝取的關(guān)鍵途徑甘露糖-6-磷酸(M6P)受體。2021年6月,該藥獲FDA批準(zhǔn)上市,用于治療1歲及以上的晚發(fā)性龐貝病患者。2022年7月,注射用艾夫糖苷酶α的上市申請(JXSS2200029)獲CDE受理,隨后被納入優(yōu)先審評,擬用于龐貝病患者的長期酶替代治療。
注射用艾夫糖苷酶α項(xiàng)目進(jìn)度

來源:米內(nèi)網(wǎng)項(xiàng)目進(jìn)度數(shù)據(jù)庫
龐貝病是由溶酶體中的酸性α-葡萄糖苷酶(GAA)的遺傳缺陷或功能障礙引起的一種疾病,已被納入中國《第一批罕見病目錄》。據(jù)此前賽諾菲披露的一項(xiàng)頭對頭Ⅲ期COMET研究顯示,注射用艾夫糖苷酶α可顯著提高龐貝病患者步行距離及改善其呼吸功能指標(biāo)。
第一批罕見病目錄
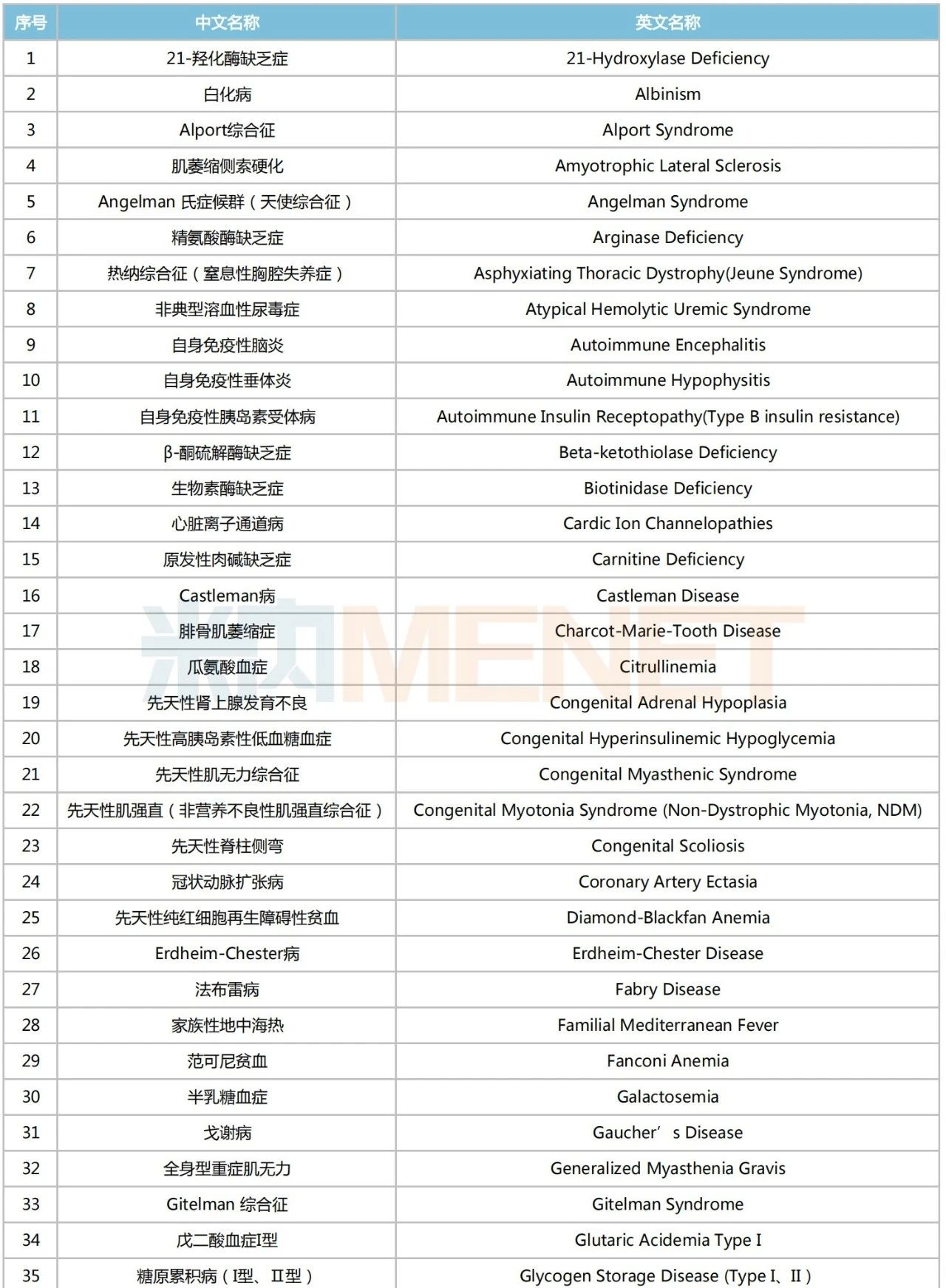
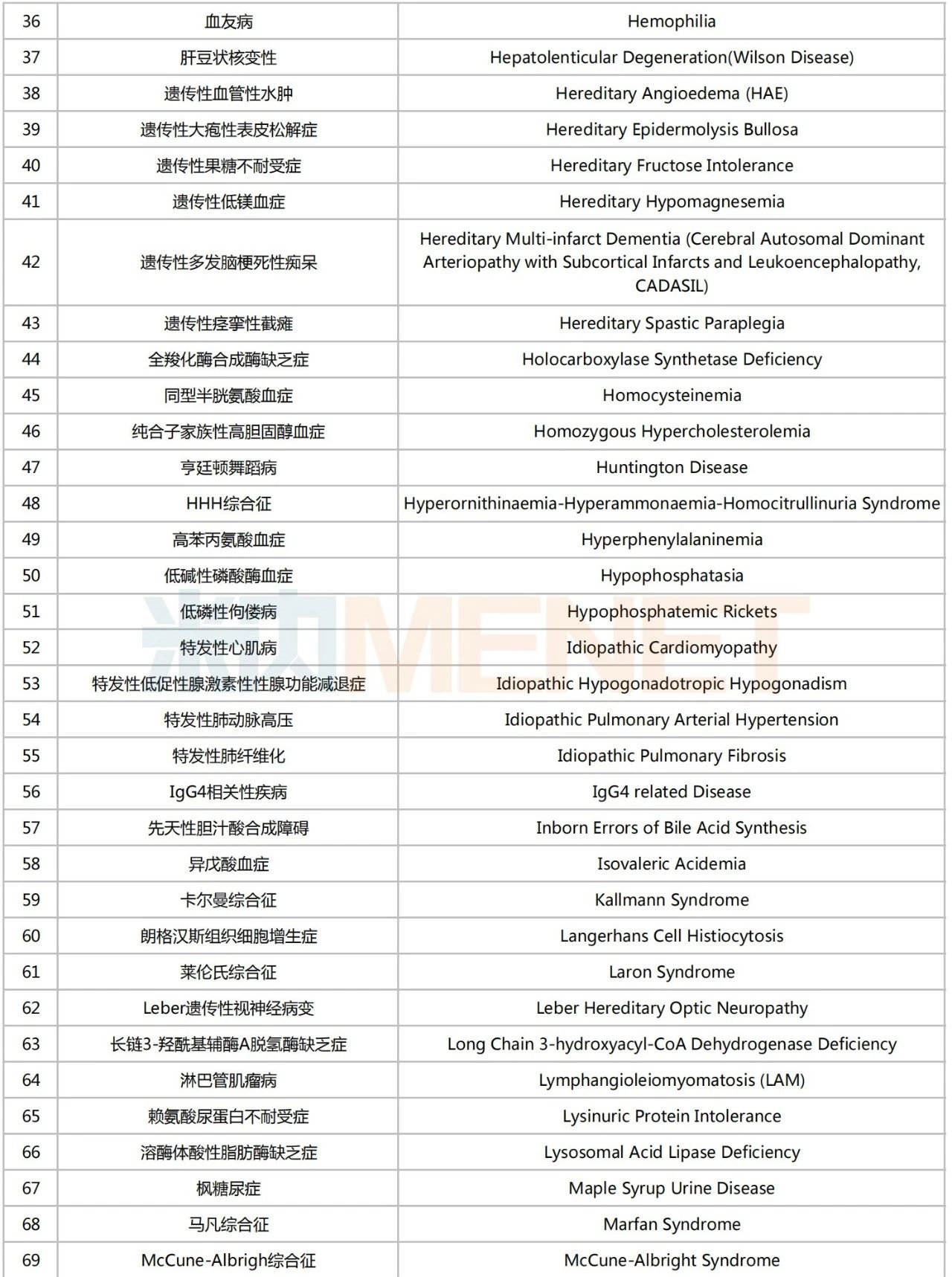

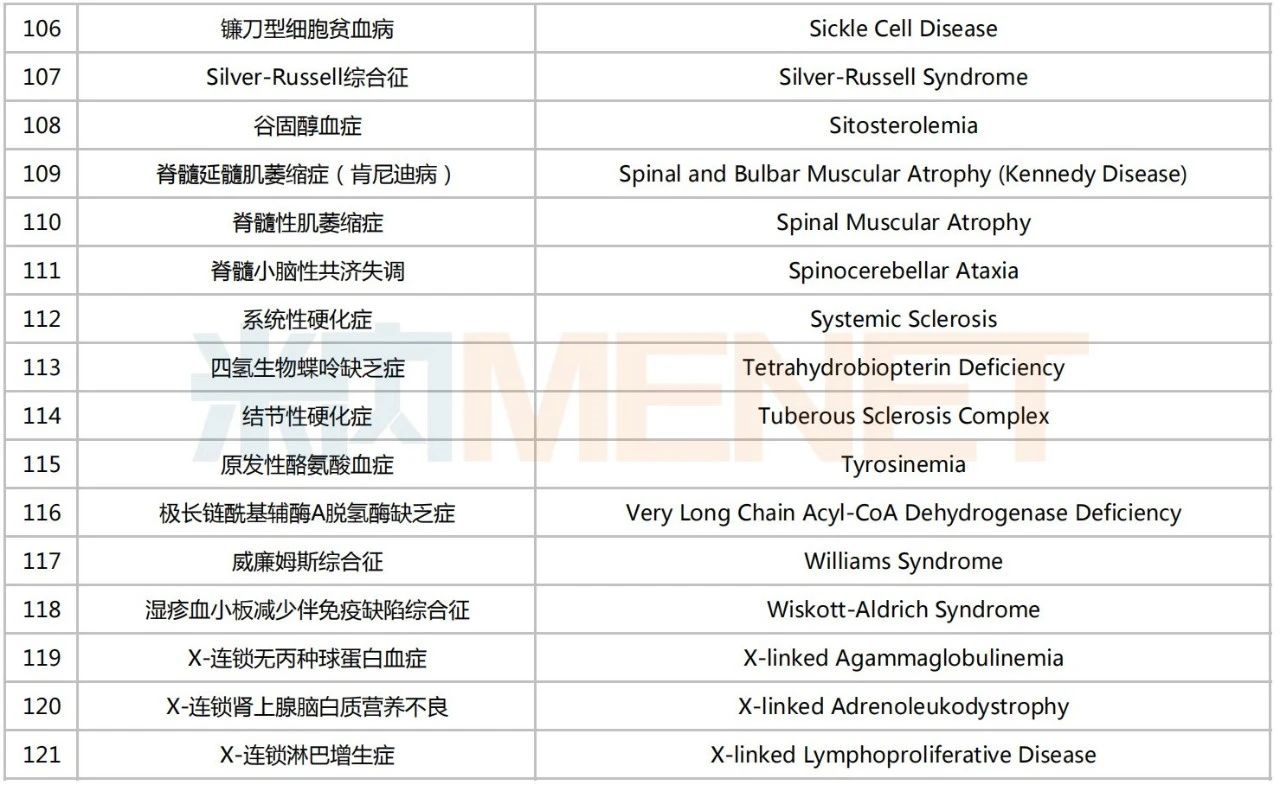
來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、國家衛(wèi)健委、國家醫(yī)保局等
注:米內(nèi)網(wǎng)《中國公立醫(yī)療機(jī)構(gòu)藥品終端競爭格局》,統(tǒng)計(jì)范圍是:中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院,不含民營醫(yī)院、私人診所、村衛(wèi)生室;上述銷售額以產(chǎn)品在終端的平均零售價計(jì)算。數(shù)據(jù)統(tǒng)計(jì)截至2月24日,如有疏漏,歡迎指正!

